產品中心
PRODUCT CENTER

一步法DNA和RNA清除試劑盒
|
貨號 |
產品名稱 |
產品規格 |
||
|
AV101 |
BcMag? 一步法DNA和RNA清除試劑盒 |
1ml |
|
|
|
AV102 |
BcMag? 一步法DNA和RNA清除試劑盒 |
3ml |
|
運輸和儲存:收到試劑盒后,將試劑盒組分儲存在-20°C。
配方:液體成分(50 mM Tris-HCl,pH 8.0、50 mM NaCl,5 mM MgCl2和50%甘油)
活性:1μl磁珠將在37°C下于30分鐘內在50 mM Tris-HCl,pH 8.0、50 mM NaCl,2 mM MgCl2中,可將10μg超聲處理的鮭魚精子DNA降解成酸溶性寡核苷酸。
裝運:在常溫環境下裝運(在室溫下至少穩定20天)。收到后,將核酸酶磁珠保存在-20°C。等分試樣以避免反復冷凍和解凍。
使用我們的一步DNA和RNA清除試劑盒,可以有效去除樣品中的DNA和RNA。簡化的方案、可靠的結果和簡單的操作使其成為您DNA和RNA去除需求的完美選擇。
簡介
BcMag ? 一步法DNA和RNA清除試劑盒使用核酸內切酶固定的磁珠,僅需一步操作就可從樣品中去除DNA和RNA。重組核酸內切酶是在大腸桿菌中合成的馬其頓沙雷氏菌的超純重組核酸內切酶(由與默克苯甲酸酶核酸酶或渦輪核酸酶同一基因編碼)。這種核酸酶可以非特異性地將各種DNA和RNA變體(包括單鏈和雙鏈DNA和RNA)消化為長度為2-8個堿基的5"-磷酸化寡核苷酸,并且不具有蛋白酶活性。含有核酸酶的核酸酶磁性顆粒能有效去除蛋白質溶液中的所有核酸(DNA和RNA),且由于核酸酶與磁性顆粒以共價鍵穩定結合,溶液中不會殘留核酸內切酶。
應用方向
強效核酸酶磁珠是去除純化蛋白或其他生物樣品制備中核酸污染的理想工具。
特點與優勢
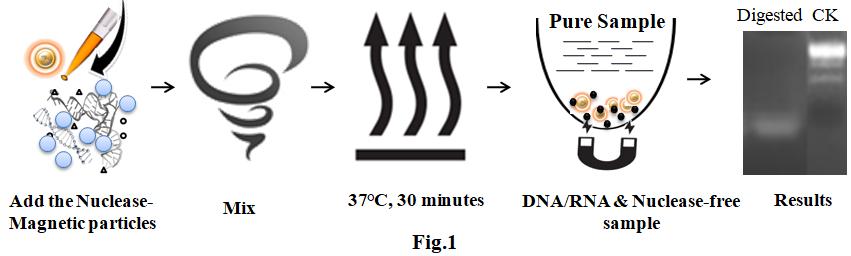
l 高效的一步法無萃取流程(見圖一)
l 快捷:可在不到30分鐘的時間內處理96個生物樣本,手動操作時間不超過10秒。
l 反應結束后可對回收的磁珠進行核酸酶恢復,以便于重復使用
l 使用者可非常簡便的從蛋白質樣品中分離出核酸內切酶磁珠
l 核酸內切酶非常穩定的與磁珠結和
l 性價比高:無需離心柱、過濾器、不用反復的重復移液和使用有機試劑。
l 可用于高通量實驗:與許多不同的全自動核酸提取系統兼容。
使用協議
A.材料準備
|
Item |
Source |
|
磁力分離器
**根據樣品體積,用戶可以選擇以下磁力分離器之一 |
BcMag? separator-2 適用于兩個單獨的1.5毫升離心管 (Bioclone, Cat.# MS-01); BcMag? separator-6 適用于六個單獨的1.5毫升離心管 (Bioclone, Cat.# MS-02); BcMag? separator-24 適用于24個單獨的1.5-2.0 ml離心管 (Bioclone, Cat.# MS-03); BcMag? separator-50 適用于1個單獨的50毫升離心管,1個單獨的15毫升離心管, 以及4個 1.5毫升 離心管 (Bioclone,Cat.# MS-04) |
|
BcMag 96孔磁力分離器 |
BcMag 96-well Plate Magnetic Separator (side-pull,) 或者 96-well PCR plate 和 96-well microplate, 或其他兼容的磁力分離器(Blioclone, Cat#: MS-06) |
B.操作過程
l 不要使用含有有機溶劑的緩沖液。
l 通常情況下,可直接向含有任何普通緩沖液的受污染的核酸中加入所需量的核酸內切酶顆粒。但是,為了獲得最佳結果,用戶應參考下表。
工作條件表
|
條件 |
最佳條件 |
工作范圍 |
抑制作用 |
|
Mg2+ |
1-2 mM |
1–9 mM |
N/A |
|
Dithiothreitol (DTT) |
0–95 mM |
>100 mM |
N/A |
|
2-Mercaptoethanol |
0–90 mM |
>100 mM |
N/A |
|
Temperature |
37 °C |
0–50 °C |
N/A |
|
Monovalent cation (Na+, K+, etc.) |
0–20 mM |
0–150 mM |
N/A |
|
pH |
8.0–9.0 |
6.0–10.0 |
N/A |
|
PMSF |
1 mM |
|
|
|
CaCl2 |
N/A |
N/A |
100 mM降低 75% 酶活性 |
|
1M NaCl |
N/A |
N/A |
1 M降低75% 酶活性
|
|
Guanidine HCl |
N/A |
N/A |
100 mM,完全抑制酶活力 |
|
EDTA |
N/A |
N/A |
1mM降低 30% 酶活力 100 mM 完全抑制酶活力 |
1. 震動試劑瓶,使磁珠完全重新懸浮,直至均勻。
重要提示:在分液前將磁珠混合是非常重要的。并且在分液完成前,不要讓磁珠溶液靜置停留超過2分鐘。每2分鐘重新懸浮一次磁珠。
2. 在含有核酸的蛋白質樣品中加入適量的磁性顆粒
3. 在1-2分鐘內緩慢上下移液吹吸20-25次,將樣品與磁珠混合,或以2000 rpm的轉速旋
轉樣品2分鐘。
4. 在37°C下培養30分鐘。
5. 將含有樣品的試管放在磁力分離器上30秒或直到溶液澄清。(選項:以3500 rpm的轉速
離心45秒)
6. 將上清液轉移到另一個干凈的板/管中,同時將原樣品板保留在磁力分離器上。純化好的
樣品已可以用于下游應用。
C.參考資料
1. Lehman, I.R., Nussbaum A.L., The deoxyribonucleases of Escherichia coli. V. On the specificity of exonuclease I
(phosphodiesterase), J. Biol. Chem., 239, 2628-2636, 1964.
2. Werle, E., et al., Convenient single-step, one tube purification of PCR products for direct sequencing, Nucleic Acids Res.,
22, 4354-4355, 1994.
3. Nabavi S., Nazar R.N., Simplified one tube “megaprimer” polymerase chain reaction mutagenesis, Anal Biochem., 2, 346-
348, 2005.
4. Rosamond, J., et al., Modulation of the action of the recBC enzyme of Escherichia coli K-12 by Ca2+, J. Biol. Chem., 254,
8646-8652, 1979.
5. Sasaki, Y., Miyoshi, D. and Sugimoto, N., Regulation of DN nucleases by molecular crowding., Nucleic Acids Res., 35,
4086-4093, 2007.
6. References 1. Lehman, I.R. and Nussbaum, A.L. (1964) J. Biol. Chem. 239, 2628. 2. Kusher, S.R. et al., (1971) Proc. Natl.
Acad. Sci. USA 68, 824. 3. Kusher, S.R. et al., (1972) Proc. Natl. Acad. Sci. USA 69, 1366. 4. Goldmark, P.J. and Linn, S. (1972) J. Biol. Chem. 247, 1849. 5. Rosamond, J. et al., (1979) J. Biol. Chem. 254, 8646.