產品中心
PRODUCT CENTER
IDA-His-標簽蛋白純化試劑盒
|
Cat. No. |
Product Name |
Unit Size |
|
|
|
MHN101 |
BcMag? IDA-Ni His-標簽蛋白純化試劑盒 |
5 ml |
|
|
|
MHN102 |
BcMag? IDA-Ni His-標簽蛋白純化試劑盒 |
10 ml |
|
|
|
MHN103 |
BcMag? IDA-Ni His-標簽蛋白純化試劑盒 |
50 ml |
|
|
|
MHO101 |
BcMag? IDA-Co His-標簽蛋白純化試劑盒 |
5 ml |
|
|
|
MHO102 |
BcMag? IDA-Co His-標簽蛋白純化試劑盒 |
10 ml |
|
|
|
MHO103 |
BcMag? IDA-Co His-標簽蛋白純化試劑盒 |
50 ml |
|
|
產品屬性 |
|
|
組成 |
表面連接有 Ni2+ 或者 Co2+磁珠 |
|
磁力大小 |
~60 EMU/g |
|
磁化類型 |
超順磁性 |
|
有效密度 |
2.5 g/ml |
|
濃度 |
100 mg/ml (1% NiSO4.6H2O or 1% CoCl26H2O) |
|
結合能力 |
>2mg His-標簽 GFP /ml 磁珠 |
|
儲存 |
儲存在 4°C |
運輸條件: 常溫運輸
儲存條件: 在4oC儲存試劑盒.
簡介
BcMag? IDA 磁珠是直徑為5μm,高度均勻的,表面共價連接有高密度IDA(亞氨基二乙酸酯)基團的IMAC磁性微球。它被設計用于從各種類型生物樣品中捕獲和純化帶有組氨酸標簽的重組蛋白質。該微球結合了IMAC蛋白純化的所有優點((成本低、操作簡單、高特異性和大容量)和磁性,在使用手動操作或自動化快速高通量純化操作過程都適用。Bioclone公司生產出兩種帶不同離子的IDA磁珠用于His-tag蛋白純化;BcMag? IDA-Ni2+磁珠和BcMag? IDA-Co2+磁珠。目前,最常用的蛋白純化金屬離子是鎳離子(Ni2+)用于His標簽融合蛋白的純化,因為它具有極高的結合量,而鈷離子(Co2+)可以提供純化蛋白更高的純度,但蛋白結合量較低。
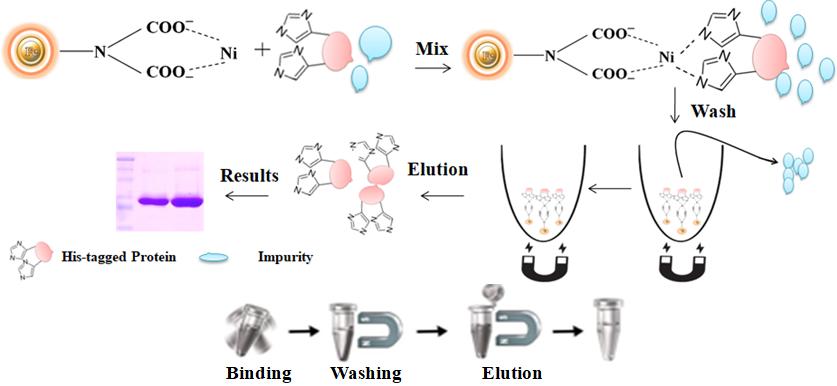
Workflow
用磁性微粒進行蛋白純化的操作過程非常簡單(圖1)。只需要將磁性微粒與細胞裂解物混合,并連續旋轉培養足夠時間。在混合過程中,保持磁珠懸浮在樣品溶液中,使目標蛋白質與被固定的配體充分結合。孵育后,收集磁珠,并使用磁力分離器將磁珠從樣品中分離。然后,用過含咪唑的洗脫緩沖液洗脫下純化后的His標簽的重組蛋白。
優勢及特點
l 快捷,簡單的一步法高通量操作;無需純化柱或過濾器,或重復移液、離心等操作。
l 穩定的共價鍵,最少的配體泄漏
l 極高結合能力,非常低的非特異性結合率
l 可根據實驗條件對樣品體積進行調整,便于自動化操作
l 產品重復效果好
產品應用
l 研究蛋白質結構和功能
l X射線晶體學的重組蛋白的制備
l 是研究蛋白質,與蛋白質或DNA相互作用的理想選擇材料
l 在免疫研究中,提高抗體與對應蛋白的結合和能力
l 即使使用粗細胞裂解液,也能有效篩選出表達的蛋白質
l GST標簽蛋白的微量純化
背景信息
多聚組氨酸標簽,也稱為6xHis標簽,和His標簽,是從各種表達系統(包括細菌、酵母、植物細胞和哺乳動物細胞系統)中純化重組蛋白的通用工具。該標簽是位于重組蛋白的N或C末端的包含六個或更多個連續組氨酸的殘基。由于這個氨基酸鏈體積非常小,His標簽具有幾個獨特的特性,包括較少的免疫原性、親水性以及可在天然和變性條件下都可發揮作用的用途廣泛性。此外,不需要從重組蛋白上切割標簽,因為它不會干擾其融合蛋白的結構和功能。His標簽的純化原理基于固定化金屬離子親和層析(IMAC)。
固定化金屬離子親和層析(IMAC)是一種快速的親和純化層析技術,是基于攜帶his標簽的重組蛋白質對Ni2+或Co2+的親和力從而達到分離目的,而Ni2+或Co2+則被結合固定到固相基質表面,例如珠狀瓊脂糖或純化柱。在pH 7-8時,His標簽蛋白將與Ni2+或Co2+結合。His標簽重組蛋白質的結合反應受到各種自變量的影響,如pH、溫度、鹽類型、鹽濃度、固定化的金屬和配體密度以及蛋白質大小。可通過降低pH梯度、增加咪唑濃度或在緩沖液中加入EDTA螯合劑來洗脫結合的蛋白質。該技術是快速、直接捕獲和純化帶標簽重組蛋白的,高性價比的理想工具。
盡管IMAC是一種非常有效的蛋白質純化技術,但這種技術主要用于傳統的親和層析基質,如瓊脂糖樹脂或純化柱。使用這些固體基質進行純化過程非常繁瑣、耗時,無法處理體積非常微小的樣品,并且難以適應自動化系統。因此,我們研發出了一種非常有效的磁珠IMAC分離產品來克服這些限制。
相關文獻
1. Jansen, J-C. (Editor). (2011). Protein Purification: Principles, High-Resolution Methods, and Applications. 3rd edition. Volume 151 of Methods of Biochemical Analysis. John Wiley & Sons, Hoboken, NJ
2. Bornhorst, J.A. and Falke, J.J. (2000). Purification of Proteins Using Polyhistidine Affinity Tags. Methods Enzymol. 326: 245-254.
3. Spriestersbach A, Kubicek J, Sch?fer F, Block H, Maertens B. Purification of His-Tagged Proteins. Methods Enzymol. 2015;559:1-15. doi: 10.1016/bs.mie.2014.11.003. Epub 2015 May 4. PMID: 26096499.
4. Zhang C, Fredericks D, Longford D, Campi E, Sawford T, Hearn MT. Changed loading conditions and lysate composition improve the purity of tagged recombinant proteins with tacn-based IMAC adsorbents. Biotechnol J. 2015 Mar;10(3):480-9. doi: 10.1002/biot.201400463. Epub 2014 Oct 31. PMID: 25303209.
5. Pina AS, et al. (2014) Affinity tags in protein purification and peptide enrichment: An overview. Methods in molecular biology (Clifton, N.J.) 1129: 147-168.
6. Young CL, et al. (2012) Recombinant protein expression and purification: A comprehensive review of affinity tags and microbial applications. Biotechnol J 7(5): 620-634.